Por el Dr. Richard Lamar
Director Sénior de investigación de sustancias húmicas
Bio Huma Netics, Inc.
 Durante siglos, se creía que los ácidos húmicos (HA) estaban compuestos por moléculas mucho más grandes que las que se encuentran en los ácidos fúlvicos (FA). Sin embargo, la aplicación de la espectrometría de masas por resonancia de ciclotrón iónica por transformada de Fourier (FT-ICR MS), que separa moléculas según el peso molecular, demuestra que los pesos moleculares de las dos fracciones se encuentran en el rango de 200 a 800 daltons (Da), mientras que la mayoría de las moléculas tienen un peso en el rango de 200 a 400 Da (Figura 1). Para tener una idea más clara, el carbono (C) pesa 12 Da, el oxígeno (O) pesa 16 Da y el hidrógeno (H) pesa 1 Da. Por lo tanto, las moléculas de fenol (un compuesto orgánico aromático, también denominado ácido fénico), que tienen 6 átomos de C, 1 átomo de O y 11 átomos de H, pesan 99 Da.
Durante siglos, se creía que los ácidos húmicos (HA) estaban compuestos por moléculas mucho más grandes que las que se encuentran en los ácidos fúlvicos (FA). Sin embargo, la aplicación de la espectrometría de masas por resonancia de ciclotrón iónica por transformada de Fourier (FT-ICR MS), que separa moléculas según el peso molecular, demuestra que los pesos moleculares de las dos fracciones se encuentran en el rango de 200 a 800 daltons (Da), mientras que la mayoría de las moléculas tienen un peso en el rango de 200 a 400 Da (Figura 1). Para tener una idea más clara, el carbono (C) pesa 12 Da, el oxígeno (O) pesa 16 Da y el hidrógeno (H) pesa 1 Da. Por lo tanto, las moléculas de fenol (un compuesto orgánico aromático, también denominado ácido fénico), que tienen 6 átomos de C, 1 átomo de O y 11 átomos de H, pesan 99 Da.
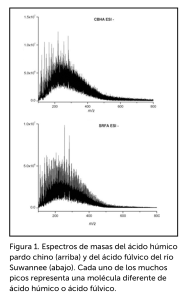 Lo que realmente separa el HA del FA es la menor cantidad de oxígeno presente en las moléculas del HA (en promedio, del 36 % al 40 % de oxígeno), en comparación con las moléculas del FA (en promedio, del 48 % al 52 % de oxígeno), según la fuente. En las sustancias húmicas, el oxígeno está presente especialmente en forma de ácidos carboxílicos (es decir, COOH), fenoles (es decir, Ar-OH; “Ar” significa aromático), alcoholes y grupos carbonilos (es decir, C=O). Estos grupos funcionales que contienen oxígeno realizan dos funciones importantes que tienen un efecto importante en el comportamiento químico de las HS. Estas funciones son las siguientes: (1) la capacidad de formar enlaces de hidrógeno (por ejemplo, con H2O), que mejora su solubilidad, y (2) la tenencia de cargas negativas para COOH y Ar-OH, cuando se pierde H+ de los grupos OH de COOH y Ar-OH. Esta segunda función es lo que hace a las HS ácidas. Según su ubicación en una molécula, los grupos COOH pueden perder un H+, y el O del OH se convierte en una carga negativa, mientras se aumenta el pH de 1 a 4. Los grupos fenólicos de OH pueden perder un H+, y el O se convierte en una carga negativa, mientras se aumenta el pH de 7 a 9.
Lo que realmente separa el HA del FA es la menor cantidad de oxígeno presente en las moléculas del HA (en promedio, del 36 % al 40 % de oxígeno), en comparación con las moléculas del FA (en promedio, del 48 % al 52 % de oxígeno), según la fuente. En las sustancias húmicas, el oxígeno está presente especialmente en forma de ácidos carboxílicos (es decir, COOH), fenoles (es decir, Ar-OH; “Ar” significa aromático), alcoholes y grupos carbonilos (es decir, C=O). Estos grupos funcionales que contienen oxígeno realizan dos funciones importantes que tienen un efecto importante en el comportamiento químico de las HS. Estas funciones son las siguientes: (1) la capacidad de formar enlaces de hidrógeno (por ejemplo, con H2O), que mejora su solubilidad, y (2) la tenencia de cargas negativas para COOH y Ar-OH, cuando se pierde H+ de los grupos OH de COOH y Ar-OH. Esta segunda función es lo que hace a las HS ácidas. Según su ubicación en una molécula, los grupos COOH pueden perder un H+, y el O del OH se convierte en una carga negativa, mientras se aumenta el pH de 1 a 4. Los grupos fenólicos de OH pueden perder un H+, y el O se convierte en una carga negativa, mientras se aumenta el pH de 7 a 9.
Para repasar las definiciones funcionales de los HA y FA: los FA son solubles en agua en cualquier condición de pH, mientras que los HA son solubles en agua solo en condiciones alcalinas. Por lo tanto, en un extracto alcalino fuerte, como el Huma Pro® 16 (con un pH de 11 a 12), tanto los HA como los FA son solubles, sobre todo porque se convierten en sales (por ejemplo, sales de potasio), tienen carga completamente negativa, y las moléculas de carga negativa se separan y se repelen. Si se disminuye el pH a 1, por ejemplo, con ácido clorhídrico concentrado (HCI), los grupos COOH y Ar-OH vuelven a recibir protones (es decir, se añade un átomo de H a los grupos COO– y Ar-O– de carga negativa), el HA se precipita porque ya no hay cargas negativas para repeler las moléculas de HA y ya no es soluble en agua.
Las moléculas de FA, que poseen abundante COOH, Ar-OH y otros grupos funcionales que contienen oxígeno, permanecen en la solución, porque la presencia de todos estos grupos posibilita el enlace de hidrógeno con H2O.
En cambio, las moléculas de HA, que tienen una cantidad limitada de grupos funcionales que contienen oxígeno y que no poseen suficiente fuerza por medio del enlace de hidrógeno, en comparación con el tamaño de las moléculas, para mantenerlas solubles, se vuelven más hidrófobas (es decir, repelen el H2O). En consecuencia, las moléculas de HA comienzan a formar agregados hidrófobos, que finalmente causan su precipitación. De esta forma, cuando se añade Huma Pro® 16 a un fertilizante altamente ácido (por ejemplo, Super Phos®), el HA se precipita y suele obstruir la boquilla del aspersor. [Consulte nuestro video sobre Cómo mezclar ácidos húmicos líquidos con agroquímicos.]
El mensaje final es que los HA son diferentes de los FA, pero no por su tamaño molecular relativo. Principalmente, difieren porque las moléculas de FA tienen más cantidad de grupos funcionales que contienen oxígeno, lo que les permite, por medio de enlaces de hidrógeno, permanecer solubles en agua, incluso en valores de pH muy ácidos.
